本文目录一览:
1、重组疫苗
图片来源@视觉中国
文 | 同写意,作者丨不器,
Novavax终于用“新冠重组蛋白疫苗”的想法,敲开了美国市场的大门。7月13日,FDA对这款名为Nuvaxovid(NVX-CoV2373)的产品进行紧急使用授权(EUA),以两剂的形式提供给18岁及以上的成人用于预防新冠肺炎。这意味着,该监管机构批准了首款基于蛋白技术路线的新冠疫苗。
尽管Nuvaxovid的接种还需取得美国CDC的认可,不过这通常不用太久。按照计划,相关独立疫苗顾问委员会将在7月19日召开会议。或许更应该担心的是,Nuvaxovid的商业化机会有多大?
投资大师索罗斯是把握趋势的高手,从他这里延伸出一个“索罗斯时刻”的概念,用以指代某个大趋势即将发生的关键点。2020年,BioNtech/辉瑞和Moderna两款新冠mRNA疫苗的获批上市,可以算得上是这几家药企股价、收入齐飞的“索罗斯时刻”。但对Novavax而言呢?
从时间上说,Nuvaxovid是美国市场上拿到监管授权的第四款新冠疫苗。先发优势已被两款mRNA疫苗以及强生的腺病毒载体疫苗占据的情况下,Novavax仍存在不小的竞争压力。
故事未完待续,可是,我们仍旧可以追问,Novavax错失的和未来的可能有什么。
01 美国第四款新冠疫苗坎坷获批
Novavax曾被认为是最有前途的新冠疫苗开发商之一。美国特朗普 *** 曾在2020年预购了1.1亿剂疫苗,在此过程中投资了16亿美元。但直到美国拜登 *** 时期,Novavax才拿到预期的授权。
对这家成立数十年却在新冠疫情之前从未推出一款商业化产品的Biotech来说,质疑是长期伴随的“原罪”。以Novavax的经验,开发出与自然产生的S蛋白高度相似,足以刺激充足免疫反应且足够稳定以在制造、包装和分销过程中保持其免疫原性的S蛋白,这不免让业内人士打上一个谨慎的问号。
2020年3月,Novavax研发出一款命名为NVX-CoV2373的三聚体全长S蛋白疫苗以期自证。实验室条件下,NVX-CoV2373蛋白产生的抗体,能够干扰新冠病毒的S蛋白与人体ACE2的结合,阻断病毒感染。
可光有S蛋白还不够。重组蛋白技术路线的成功,需要额外的佐剂来帮助刺激强大的保护性免疫反应。在NVX-CoV2373的开发上,Novavax采用Matrix-M佐剂。而这,也成为Novavax落后于Moderna等采用mRNA技术同行的一大原因,毕竟后者省去了开发重组蛋白、佐剂等额外步骤。
用时间换空间——更加安全的技术疫苗接种市场——见仁见智。但接下来的挫折,恐怕就是Novavax无法回避的失误。
NVX-CoV2373的第一个III期临床选在英国和南非。这项研究的效果,甚至好过后来在美国、墨西哥开展的另一个III期表现。然而事实也证明,由于将NVX-CoV2373推入美国市场需要本土数据,Novavax不得不拉长战线,另开后一项临床,拖慢获批节奏。
好不容易拿到可用的III期结果,Novavax曾表示,2021年第三季度着手申请NVX-CoV2373的监管授权,并希望在当年第三季度和第四季度末分别达到每月1亿剂、1.5亿剂的生产能力。可是,执行上却一再延迟。
据Novavax负责全球企业事务和投资者关系的高级副总裁Silvia Taylor透露,Novavax早就在世界各地建立生产基地,起初计划让不同的基地在不同的监管方案中发挥作用。但随后,这一方案最终改为统一使用印度血清研究所(Serum Institute of India)的生产工艺和初始数据。
如此这般,Novavax错失了在2021年将NVX-CoV2373推向大规模上市的时机。直至2021年底,WHO才把Nuvaxovid纳入紧急使用清单(EUL),此后,英国、欧盟和澳大利亚等十几个国家和组织也对其放行——美国的“示好”最早还得在半年后。
6月7日,FDA疫苗和相关生物制品咨询委员会(VRBPAC)以21:0投票结果(1票弃权),建议为18岁以上的人群提供NVX-CoV2372的EUA。就在业界预期,该疫苗可能6月中旬迅速获批的时候,传出了FDA将要审查NVX-CoV2372制造过程的变化的消息。
今年1月,Novavax向FDA提出注册申请。但到4月,FDA疫苗部门的高级官员Doran Fink告诉CDC顾问,审查Novavax的申请“非常复杂”,因为它涉及临床和制造数据。
FDA不打算“抄作业”。领导FDA疫苗部门的Peter Marks曾直言,美国在疫苗方面有很高的监管标准,并且不会根据其他国家的授权做出决定。
“我们非常重视药物的制造环节,”Peter Marks对VRBPAC说,“在制造方面,我们不会将自己与其他国家进行比较,我们认为自己有一个非常高的标准,这也是为什么我们经常被认为是制造的黄金标准,特别是在疫苗领域。”
不过,好在Novavax最终通过了FDA严苛的审查。如同摩根大通的分析师预计,7月中旬,Nuvaxovid获得了入场券,将与来自BioNtech/辉瑞、Moderna等产品在美国本土市场展开正面竞争。
02 留给Novavax的“后疫情时代”
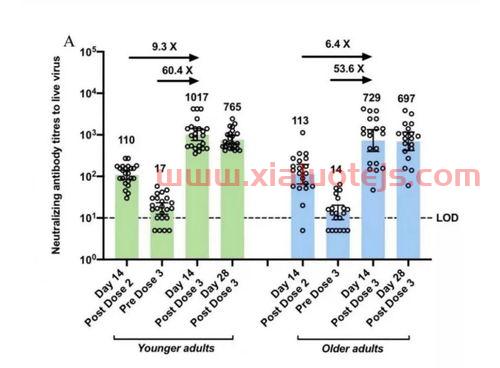
Nuvaxovid的EUA,基于2020年12月至2021年9月期间对约3万名参与者进行的III期临床研究结果。根据这一数据,Nuvaxovid在阻止轻度、中度或重度新冠肺炎的总体疗效为90.4%,其中对65岁及以上人群的有效率为78.6%。
就在几天前,美国卫生与公众服务部(HHS)、国防部同Novavax宣布一项合作,以获得320万剂Nuvaxovid。根据计划,这些疫苗剂量将免费提供给美国各州、司法管辖区、联邦药房合作伙伴和联邦合格的卫生中心。
现阶段,美国大约76%的18岁及以上成年人已接受2剂新冠疫苗,其中大部分来自是辉瑞/BioNTech和Moderna,约有2700万成年人没有接受过任何新冠疫苗。Novavax希望能为这部分人群提供更加安全的产品,因为它相信,这些群体是担心新技术而不愿接种mRNA疫苗的人。
在此前的第一季度财报中,Novavax继续表明其2022年全年40亿至50亿美元的营收指导,这与Refinitiv的预测数据相近,后者称,NVX-CoV2373有望在今年为Novavax创造约50亿美元的销售额。
不过,市场瞬息万变。6月中旬,VRBPAC召开会议,以21:0的投票结果一致赞成,将辉瑞/BioNTech和Moderna的mRNA疫苗用于12岁以下儿童群体的接种。具体来说,前者适用于6个月至4岁婴幼儿,后者适用于6个月至5岁儿童。二者获批范围的扩大,无疑会进一步分食重组蛋白技术路线可能的商业空间。
疫苗生产商更需要面对的问题是与病毒赛跑。以Nuvaxovid为例,支持其EUA的试验是在Delta和Omicron变异株出现之前进行的。
Novavax的简报文件指出,根据该临床试验中的疗效估计,Nuvaxovid更有可能提供某种有意义的保护水平对抗由于Omicron引发的新冠肺炎,特别是针对更严重的疾病。但最近,Omicron BA.5变异株已经占据了主导地位,它比早期变体更可能逃避疫苗和先前感染的免疫力。
需要指出的是,Novavax提交中的数据并不涉及Omicron BA.5。
6月28日,FDA专家小组首次提出,应针对不同变异株更换疫苗。两天后,FDA接受建议,通告要求新冠疫苗厂商在秋冬季的加强针中加入Omicron BA.4/5亚株的刺突蛋白抗原,以此来更新疫苗。
Nuvaxovid之外,Novavax还在研发一种二价疫苗(NVX-CoV2373/NVX-CoV2515),在以应对Omicron变异株。今年上半年,该III期临床已经启动,研究将持续10个月,Novavax预计最早在2022年下半年将取得初步结果。
唯一可以确定的是,拿到监管授权之后,未来也并不是那么明朗。要知道,在Novavax之前,强生也为美国市场提供了一种迥异与mRNA技术的选择——新冠重组腺病毒疫苗。然而今年5月,出于避免血栓形成和血小板减少症综合征(TTS)的考虑,FDA决定对强生Ad26.COV2.S的使用人群进行限制。
2022年第一季度的财报中,强生认为,全球新冠疫苗供应过剩和需求不确定性,决定暂不提供新冠疫苗销售指引,停止新冠疫苗的生产。平心而论,这恐怕也是需要Novavax担忧的现实。
参考资料:
1.Novavax新冠疫苗再生枝节,FDA将审查制造变更;同写意2.美国第四款新冠疫苗?那些Novavax错失的与未来的;同写意3.U.S. FDA Grants Emergency Use Authorization for Novavax COVID-19 Vaccine, Adjuvanted for Individuals Aged 18 and Over;Novavax4.FDA panel recommends changing Covid shots to fight omicron this fall;CNBC5.The Novavax vaccine against COVID-19: What you need to know;WHO12月2日,深交所向陕西金叶下发一则关注函,要求说明公司基本面是否发生重大变化;核查公司董事、监事、高级管理人员及其直系亲属是否存在买卖上市公司股票的行为,是否存在涉嫌内幕交易的情形。
据了解,自2021年11月23日以来,陕西金叶股票连续多日大幅上涨,在8个交易日内一度录得6个涨停。截至12月2日收盘,该公司累计涨幅为92.46%,累计换手率为133.8%。
对此,陕西金叶多次发布股票交易异常波动公告均称,经核查,公司控股股东及其一致行动人、实际控制人在本公司股票交易异常波动期间未买卖本公司股票。“公司不存在关于本公司的应披露而未披露的重大事项,也不存在处于筹划阶段的重大事项。”
公开资料显示,陕西金叶是国内几家烟草配套概念的上市企业之一。 经过20多年的快速发展,该公司已成长为横跨烟草配套产业、教育产业、房地产业、医养产业等多元化、多业态的大型上市公司。(文|AI财经社 夏天)
今天我去咨询注射新冠疫苗,工作人员跟大家介绍说:以后很长一段
时间都没有两针的灭活疫苗,都是三针的重组疫苗,我看到好多人都犹豫了!灭活疫苗和重组疫苗有什么区别吗!
新冠疫苗家族再“添丁” 基因重组疫苗了解一下
◎王新宇
我国新冠疫苗获批紧急使用的阵容中最近又增添了一位新成员——基因重组亚单位疫苗。这一类疫苗和之前已经获批的灭活疫苗以及腺病毒载体疫苗都不一样,其中最为大家关注的一个不同是,这种疫苗完成免疫接种程序,需要打3针,间隔6个月时间。
那么,什么是基因重组亚单位疫苗,最早的基因重组亚单位疫苗是怎么开发出来的?让我们来了解一下。
灭活疫苗和减毒疫苗的抗原都是由完整的病原体组成,而基因重组亚单位疫苗仅包含源自致病性细菌或病毒的某些成分。这些成分是高度纯化的蛋白质或合成肽,是引起机体免疫反应的主要物质。也就是说,基因重组亚单位疫苗不是完整的病原体,因此从本质上就不具备感染人体,造成疾病的能力。世界上首个利用基因重组技术生产的疫苗是乙肝疫苗。
乙肝病毒的一个独特特征是,在电子显微镜下观察,除了整个病毒颗粒外,在病毒携带者的外周血液中还发现了非常多的仅包含乙肝病毒表面抗原(HBsAg)的球形和棒状颗粒。在某些携带者中,这些颗粒占其血清蛋白总量的1%以上。这一发现构成了制造基因重组乙肝疫苗的基础。
上世纪80年代,科学家尝试利用基因重组技术,使得乙肝疫苗中的亚单位——HBsAg可以在其他生物中表达,该技术使得疫苗生产摆脱了需要人类血浆的局限,提供了几乎可以无限生产疫苗的潜力。
也就是说,科学家用人工合成的HBsAg替代了从感染者血浆中分离到的HBsAg。目前大多数获批的基因重组乙肝疫苗都是由含226个氨基酸的S基因产物(HBsAg蛋白)组成。
利用酵母生产的基因重组乙肝疫苗,是通过在含有S基因的基因工程酵母细胞(酿酒酵母或者是汉逊酵母)中表达HBsAg蛋白而制成的。表达质粒在酵母细胞中仅产生HBsAg蛋白,而不会含有真正的病毒。
这种基因重组乙肝疫苗中表达HBsAg的多肽会自动装配成22纳米的球形颗粒,类似于在慢性乙肝病毒感染者的血清中分离得到的HBsAg颗粒。这种人造的HBsAg颗粒同样含有对免疫应答起重要作用的抗原决定簇。
重组乙肝疫苗当然也并非十全十美,从苛刻的眼光来评判,其也有缺点。其中最为突出的一点是免疫原性还不够强,表现在有一小部分接种的人在接种后不能够产生保护性抗体,需要重新接种。
对此科学家们也已经研发出了含有前S区基因的重组疫苗,事实证明这种疫苗能够产生更好的保护力,但是由于制造成本要明显高于现有的疫苗,因此应用并不广泛。世界卫生组织和各国卫生部门也认为现有的基因重组乙肝疫苗已经足够好,目前并没有计划用新的疫苗来完全替代。
作为基因重组亚单位疫苗的代表,基因重组乙肝疫苗具有产量高、安全性高、易于存储和运输等优势,并且取得了巨大的成功。而采用同样技术路线开发的基因重组亚单位新冠疫苗也应该会有类似的优点。
临床研究的数据也表明,基因重组亚单位新冠疫苗在接种2剂次后,76%可产生中和抗体;接种3剂次后,97%可以产生中和抗体,抗体水平较高,能够达到康复患者的血清抗体量2倍。
由此可见,基因重组亚单位新冠疫苗在临床研究中显示出了不错的潜力。而在更大范围人群的接种中,它能否在众多新冠疫苗技术路线中脱颖而出,同样值得期待。
华山感染
今天的内容先分享到这里了,读完本文《重组疫苗》之后,是否是您想找的答案呢?想要了解更多重组疫苗、陕西金叶股票是做什么的相关的财经新闻请继续关注本站,是给小编最大的鼓励。

提取失败财务正在清算,解决方法步骤件事就是冷静下来,保持心...
本文目录一览:1、邮政银行2、东吴基金管理有限公司3、邮政...
本文目录一览:1、联发科前十大股东2、中国经济改革研究基金会...
申万菱信新动力5.23净值1、申万菱信新动力股票型证券投...

本文目录一览:1、2000年至2020年黄金价格表2、3002...